
伊藤 正惠
(いとう・まさえ)
Masae Itoh
略歴
- 神戸大学大学院医学研究科博士課程修了
- マールブルグ・フィリップス大学ウイルス研究所研究員、神戸大学医学部講師、大阪府立公衆衛生研究所主任研究員を歴任
麻疹ウイルス増殖機構の解析
亜急性硬化性全脳炎(SSPE)発症メカニズムの解明
- 研究の応用領域
- 抗ウイルス剤、ウイルス診断法の開発
- 産官学連携で求めるパートナー
- 抗ウイルス剤、ウイルス診断法開発の関連企業、大学、国・地方自治体の研究機関
ウイルス感染症の基礎・応用・臨床研究者
Emergence of a pneumopathogenic coronavirus was reported from Wuhan China in December 2019. The virus named severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) quickly spread all over the world, which resulted in the declaration of pandemic by World Health Organization causing more than hundred million infected and more than 2 million deceased persons (as of March 2021). Emerging or re-emerging infectious diseases caused by viruses is one of the most anxious issues world-wide today. An influenza virus originated from swine H1N1 virus spread around the world shortly after the first invasion into human in April 2009, and in 2014 outbreak of Ebola virus disease in western district of Africa brought a critical pandemic with high mortality. At present under the prevalence of SARS-CoV-2 in human, infection of highly pathogenic avian influenza virus often occurs in chicken ranch in Japan. Causative agents of many serious diseases such as acquired immune deficiency syndrome( AIDS), measles, hepatitis C and cattle foot-and-mouth disease are also viruses. Viruses replicate and grow by introducing their genome into their host cells and then making use of the functions there such as RNA polymerases, ribosome, vesicular transport systems and so on. Therefore, to develop rapid diagnosis systems, effective vaccines and anti viral drugs to overcome viral diseases, it is required to understand the molecular mechanisms of the viral replication and to set the target on the biological processes specific for viral replication.
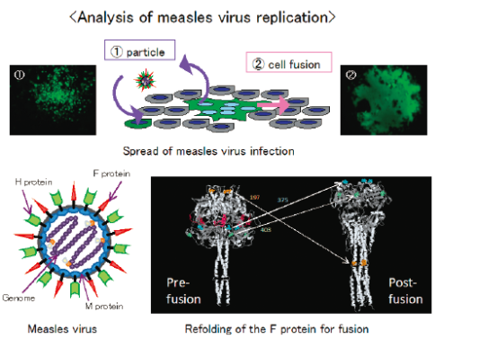
Analysis of measles virus replication

Measles viruses spread their infection by different 2 ways: firstly, they form progeny particles which adsorb and penetrate the uninfected cells apart from the infected cells, and secondly, they fuse the infected cells with the adjacent cells directly introducing viral genomes, mRNAs and proteins. Which way a measles virus adopts as a dominant route of infection depends on the abilities of the M protein to form particles as well as of the F protein to induce membrane fusion, but the precise mechanism is not yet elucidated. In our laboratory, comparing various measles virus strains with different particle-forming and fusion activities, analyses of the interaction especially between viral components and host cell factors are on the way.
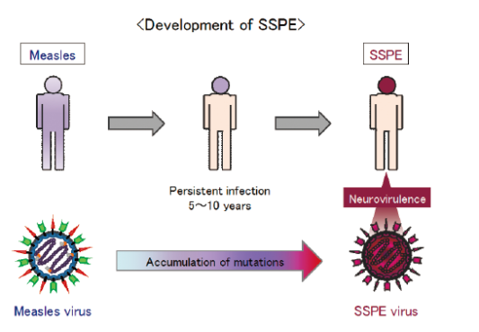
Pathogenicity of subacute sclerosing panencephalitis (SSPE) virus

SSPE is a fatal sequela associated with measles. The risk of developing SSPE was reported as 1 case per 1,300 ~ 3,300 cases of acute measles after a long latency period of 5 to 10 years. SSPE is developed by persistent infection of the central nervous system with measles virus, during which the parental measles virus acquires neurovirulence by accumulation of mutations on the genome. SSPE viruses, without exception, have lost the ability to form virus particles and obtained strong cell-cell fusion activity, however, the mechanism how SSPE viruses establish the persistent infection followed by the acquirement of neural pathogenicity is still unraveled due to the numerous mutations on their genome. Isolating a SSPE strain with the limited number of mutations from a patient who developed SSPE 5 years after acute measles, an investigation to identify mutations intrinsically substantial for the development of SSPE has been undertaken in our laboratory.
Kitagawa, Y., Sakai, M., Funayama, M., Itoh, M. and Gotoh, B. Human Metapneumovirus M2-2 Protein Acts as a Negative Regulator of Alpha Interferon Production by Plasmacytoid Dendritic Cells. J. Virol., 91(20): e00579-17. (2017)
Satoh, Y., Yonemori, S., Hirose, M., Shogaki, H., Wakimoto, H., Kitagawa, Y., Gotoh, B., Shirai, T., Takahashi, KI. and Itoh, M. A residue located at the junction of the head and stalk regions of measles virus fusion protein regulates membrane fusion by controlling conformational stability. J. Gen. Virol., 98(2): 143-154. (2017)
Satoh, Y., Hirose, M., Shogaki, H., Wakimoto, H., Kitagawa, Y., Gotoh, B., Takahashi, K. and Itoh, M. Intramolecular complementation of measles virus fusion protein stability confers cell-cell fusion activity at 37 °C. FEBS Lett., 589(1): 152-158. (2015)
Yamaguchi, M., Kitagawa, Y., Zhou, M., Itoh, M. and Gotoh, B. An anti-interferon activity shared by paramyxovirus C proteins: inhibition of Toll-like receptor 7/9-dependent alpha interferon induction. FEBS Lett., 588(1): 28-34. (2014)
Wakimoto, H., Shimodo, M., Satoh, Y., Kitagawa, Y., Takeuchi, K., Gotoh, B. and Itoh, M. F-Actin Modulates Measles Virus Cell-Cell Fusion and Assembly by Altering the Interaction between the Matrix Protein and the Cytoplasmic Tail of Hemagglutinin. J. Virol., 87(4): 1974-1984. (2013)






