
亀村 和生
(かめむら・かずお)
Kazuo Kamemura
略歴
- 三重大学大学院生物資源学研究科博士課程修了
- 科学技術振興機構、日本学術振興会、理化学研究所の研究員を経て本学へ
タンパク質修飾シグナル研究室

卒業研究テーマ例
- ユーイング肉腫の原因タンパク質EWSFli1の生化学的研究
- FUSタンパク質のストレス感受性凝集体を形成する責任ドメインの特定
- 脂肪細胞成熟分化を促進する翻訳後修飾の同定
特に、リン酸化カスケードによる細胞内情報伝達システムや、エピジェネティクスに関与する翻訳後修飾 ‘O-GlcNAc’ に注目しています。
細胞分化・がん化とO-GlcNAc修飾
神経変性疾患の原因タンパク質に起こるO-GlcNAc修飾
- 研究の応用領域
- 新しい治療薬・診断薬やサプリメントの開発への応用が期待できます。
- 産官学連携で求めるパートナー
- 動物生理学、天然物化学など異分野の研究者、上記の応用領域の展開を望まれる企業や自治体の方々。
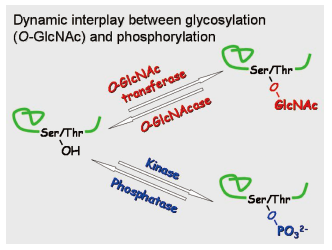
Most of the protein functions are precisely regulated by post-translational modifications( PTMs) in vivo. Especially, the physiological/pathological significance of PTM has been becoming evident according as the progress in epigenetic research.
Although more than two hundreds of PTMs have been discovered, most of their biological roles still await unveiling. Among PTMs, we are focusing on the two kinds of the nucleo-cytoplasmic PTMs, glycosylation( O-GlcNAc) and phosphorylation.
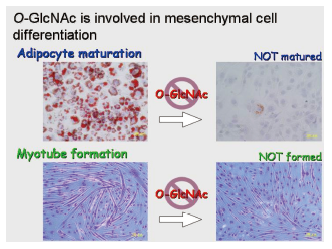
O-GlcNAc in mesenchymal cell differentiation
O-linkedβ-N-acetylglucosaminylation( O-GlcNAcylation) is a ubiquitous and abundant post-translational modification found on nucleocytoplasmic proteins in multicellular organisms. O-GlcNAcylation is essential for mouse ES cell viability and development, and is thought to be required in a tissue-specific manner at later stage. Since aberrant O-GlcNAcylation has a link with insulin resistance, it is important to establish the role of O-GlcNAc in differentiation of mesenchymal cells such as preosteoblasts, preadipocytes and myoblasts. Differentiation-specific O-GlcNAcylation of these cells is biochemically being studied.
O-GlcNAcylation of Ewing’s sarcoma proto-oncoprotein
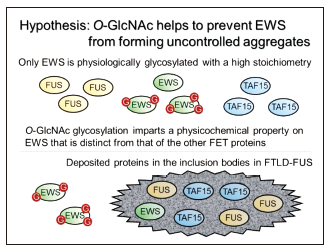
Although Ewing’s sarcoma protein( EWS) is involved in DNA recombination & repair, transcription, and RNA processing, the precise function of EWS is still unknown. Chimeric EWS oncoprotein generated by chromosomal translocations between EWSR1 and an ETS transcription factor cause malignant tumors. To understand the loss of function of the intact EWS by the translocations, the biological role of the intact EWS should be clarified. EWS is a known O-GlcNAcylated protein. To gain insight into the functional significance of the intact EWS, the biological function of O-GlcNAcylation of EWS is being studied.
Post-translational modifications of the FET proteins
Of the FET( FUS/EWS/TAF15) protein family, FUS and TAF15 are consistently and EWS variably found in inclusion bodies in neurodegenerative diseases such as frontotemporal lobar degeneration associated with FUS. Based on this circumstantial evidence, the regulatory mechanism of EWS to form fibrous assemblies seems to be distinct from that of the other FET proteins. It is speculated that dysregulation of FET proteins at the post-translational level is involved in their cytoplasmic deposition. The effect of PTMs on the fibrous assemblies of FET proteins is being studied.
Kamemura, K. O-GlcNAc glycosylation stoichiometry of the FET protein family: only EWS is glycosylated with a high stoichiometry. Biosci. Biotechnol. Biochem. 81, 541-546 (2017)
Kamemura, K., Abe H. The glycosylation stoichiometry of EWS species in neuronal cells. Biosci. Biotechnol. Biochem. 81, 165-167 (2017)
Ogawa, M., Sawaguchi, S., Kamemura, K., Okajima T. Intracellular and extracellular O-linked N-acetylglucosamine in the nervous system. Exp. Neurol. 274, 166-174 (2015)
Koyama T., Kamemura K. Global increase in O-linked N-acetylglucosamine modification promotes osteoblast differentiation. Exp. Cell Res. 338, 194-202 (2015)
Li, Q., Kamemura, K. Adipogenesis stimulates the nuclear localization of EWS with an increase in its O-GlcNAc glycosylation in 3T3-L1 cells. Biochem. Biophys. Res. Commun. 450, 588-592 (2014)






