アニマルバイオサイエンス学科
 永井 信夫(ながい・のぶお)
永井 信夫(ながい・のぶお)
Nobuo Nagai
専門分野/生理学、神経科学、血栓止血学研究キーワード/病態モデル、線溶系
職位:教授(実験動物1級技術者)
学位:博士(理学)(大阪大学)
- 大阪大学大学院生物化学専攻後期博士課程修了
- 味の素㈱中央研究所研究員、浜松医科大学生理学第二講座助手、ベルギー王国・ルーヴァン大学分子血管生物学センター研究員、近畿大学医学部第二生理学講座講師を経て本学へ
研究テーマ
実験動物のヒト病態モデルを用いた病態発現の機序の解明、および得られた知見を基にした創薬ターゲットの探索を行っています。特に、多くの疾患では病態形成に組織のリモデリングを伴うため、リモデリングに関わる線溶因子の関与をメインテーマに研究しています。また、新規のモデルの確立も研究テーマです。
1)新規病態モデルの作成と創薬ターゲット
疾患には多くの因子が関わります。そのため培養細胞だけでは発病機序の解明や治療薬・治療法の探索ができず、病態モデル動物を用いた研究が必須です。本研究室ではマウスを用いて様々な疾患モデルを作成し、そのモデルを用いて創薬ターゲットとなる分子の探索を組織学的・生化学的・生理機能的な方法を用いて評価しています。現在は、脳傷害モデル、肺塞栓モデル、皮膚疾患モデルなどを確立しています。
2)線溶因子の機能の解明
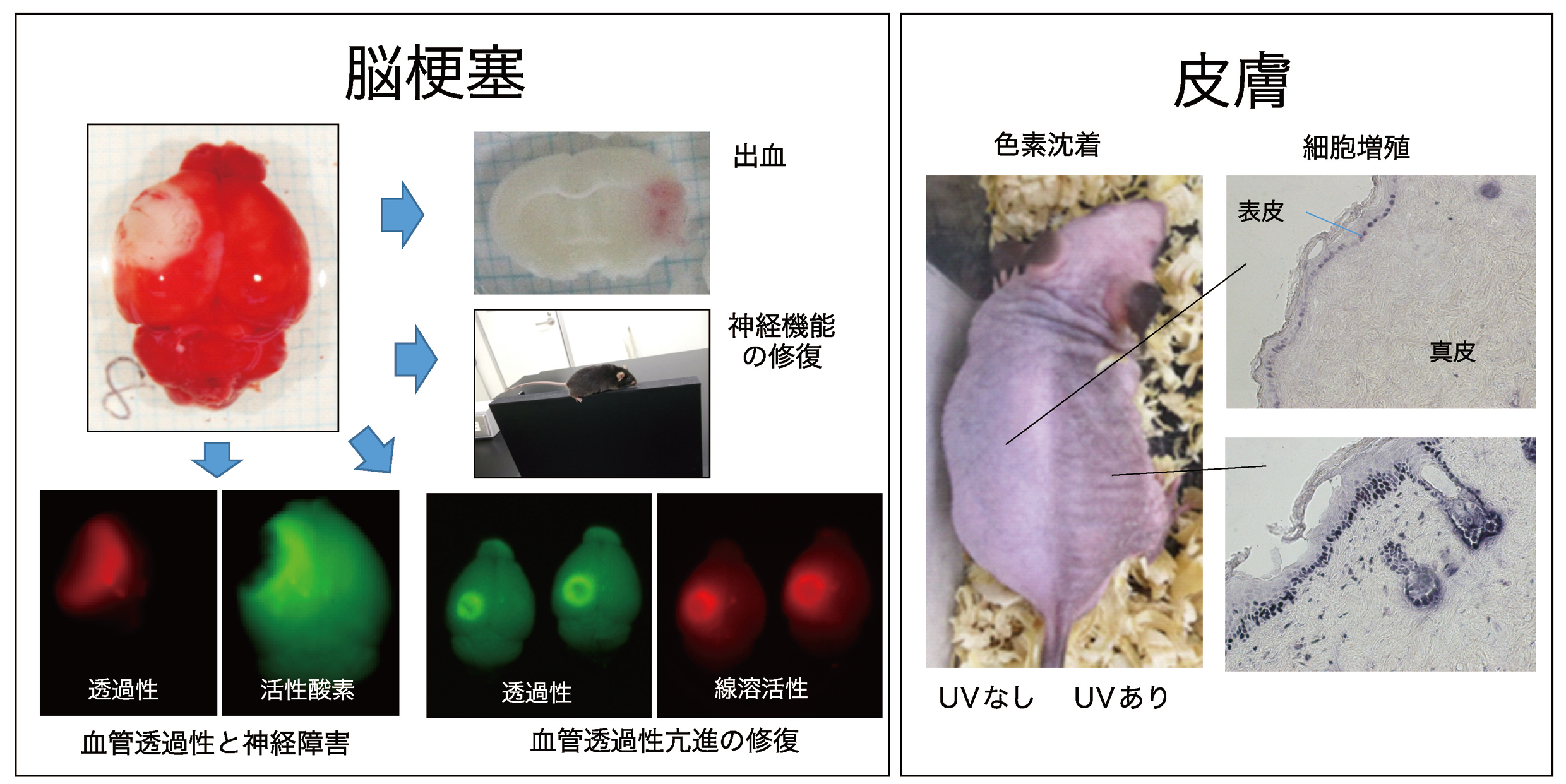
線溶系は「血栓溶解」および「組織リモデリング」に関わる細胞外タンパク質分解システムです。多くの疾患では組織リモデリングを伴うため、線溶系の構成因子(線溶因子と呼びます)を創薬のターゲットとしてとらえ、その機能を研究しています。現在は、特に脳梗塞に伴う血管透過性亢進・出血および神経機能の修復に寄与する分子機序の解明、皮膚の神経過敏や光老化における病態形成機序を研究しています。これまでに線溶因子のtPAが脳梗塞に及ぼす影響や出血を起こすメカニズムの解明、同じく線溶因子であるプラスミンの誘導体の抗脳梗塞薬としての開発を行って来ました。
| 研究の応用領域 | 産官学連携で求めるパートナー |
|---|---|
| 医薬品・診断薬の開発、創薬分野の新技術開発 | 医薬品・診断薬開発の関連企業、大学、国・地方自治体の研究機関 |
Topics of research
In our laboratory, we study mechanisms of pathogenesis of various disease by using experimental animals and survey novel therapeutic targets. Especially, since tissue remodeling is associated with many diseases, we focus to study the roles of fibrinolytic components which is involved in tissue remodeling.
1) Establishment of new animal model and drug development target
Since many factors are involved in the pathogenesis of diseases, animal models are required for studying their pathogenic mechanisms. We are, therefore, developing novel animal models. By using these models, we try to clarify the mechanisms and find novel therapeutic targets.
2) Roles of fibrinolytic system components
The fibrinolytic system is a extracellular protease cascade with is involved not only fibrinolysis but also tissue remodeling. Since tissue remodeling is important for pathogenesis in various disease, We now studies the roles of the fibrinolytic system components. Especially, we focus on ischemic stroke, hypersensitivity and photo-aging of skin.
主な業績論文等
- Kunoh T, Wang W, Kobayashi H, Matsuzaki D, Togo Y, Tokuyama M, Hosoi M, Koseki K, Wada S, Nagai N, Nakamura T, Nomura S, Hasegawa M, Sasaki R, Mizukami T. Human Dynactin-Associated Protein Transforms NIH3T3 Cells to Generate Highly Vascularized Tumors with Weak Cell-Cell Interaction. PLoS One. 2015 ; 10 : e0135836.
- Suzuki Y, Nagai N, Yamakawa K, Muranaka Y, Hokamura K, Umemura K. Recombinant tissue-type plasminogen activator transiently enhances blood-brain barrier permeability during cerebral ischemia through vascular endothelial growth factor-mediated endothelial endocytosis in mice. J Cereb Blood Flow Metab. 2015 ; 35 : 2021-31.
- Suzuki Y, Nagai N, Umemura K. A Review of the Mechanisms of Blood-Brain Barrier Permeability by Tissue-Type Plasminogen Activator Treatment for Cerebral Ischemia. Front Cell Neurosci. 201; 10:2.
- Ohmori C, Sakai Y, Matano Y, Suzuki Y, Umemura K, Nagai N. Increase in blood-brain barrier permeability does not directly induce neuronal death but may accelerate ischemic neuronal damage. Exp Anim. 2018; 67: 479-486.
- Matano Y, Nojiri Y, Nomura M, Masuda A, Moriike Y, Suzuki Y, Umemura K, Nagai N. Repair of brain damage size and recovery of neurological dysfunction after ischemic stroke are different between strains in mice: evaluation using a novel ischemic stroke model. Exp Anim. 202; 70: 344-354.






