特任教授、名誉教授
 水上 民夫(みずかみ・たみお)
水上 民夫(みずかみ・たみお)
Tamio Mizukami
専門分野/ゲノム創薬科学、がん分子標的治療学
研究キーワード/がん、創薬、人工知能(AI)、細胞可視化
職位:教育担当特任教授、名誉教授
学位:農学博士(京都大学)
- 京都大学大学院農学研究科修士課程修了
- 米国NIH客員研究員、協和発酵工業㈱東京研究所主任研究員等を歴任
研究テーマ
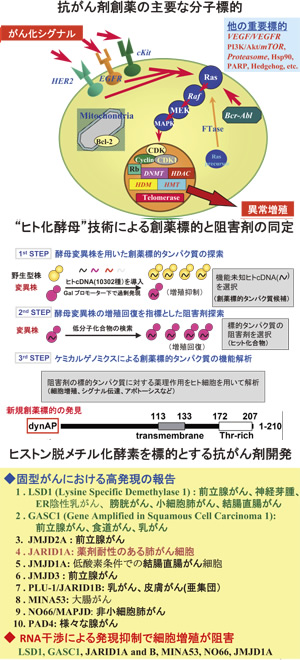
1980年代のヒトがん遺伝子やがん抑制遺伝子の発見により、がんが遺伝子疾患であることが証明され、それ以来、がん遺伝子産物を標的とした抗がん剤の創薬が活発に進められてきました。特に過去10数年間、がん遺伝子産物などをターゲットとする分子標的抗がん剤の開発は大きな成功を収め、現在世界で90近くのがん分子標的治療薬が承認されています。本研究室では創薬標的遺伝子や創薬リード化合物の探索・同定技術の開発、またがん遺伝子産物やエピジェネティクスをターゲットとする分子標的抗がん剤の創薬を展開しています。また最近は、培養細胞に対する新規なイメージング技術の開発に取り組んでいます。
(1)“ヒト化酵母”技術による新規創薬標的の同定と阻害剤開発
本テーマでは、ヒト遺伝子を発現させた出芽酵母(ヒト化酵母)を利用しています。本システムにより同定したタンパク質の一つは、モータータンパク質のダイナクチンとの相互作用が判明し、dynAP(dynactinassociatedprotein)と命名しました。dynAPを発現させた細胞はヌードマウスで腫瘍を形成し、その腫瘍は豊富な血管を持ち、細胞間の接着が緩んだ独特の構造を取るなど、興味深い性質を持つことを見出しました。現在、dynAP の機能を阻害する抗がん剤の開発を進めています。
(2)ヒストンメチル化修飾を標的とするエピジェネティクス制御創薬
エピジェネティクス異常は多くのがんで認められ、新世代の分子標的抗がん剤の創薬標的として大きな注目を集めています。中でもがんでの遺伝子増幅や発現亢進が観察されているヒストン脱メチル化酵素のLSD1/LSD2やJARID1A、GASC1、PHF8を標的として阻害剤の開発に取組み、多数のリード化合物の同定に成功しています。
(3)培養細胞に対する新規なイメージング技術の開発
2次元/3次元で培養した細胞あるいは細胞凝集体であるスフェロイドの新規なイメージング技術を開発し、抗がん剤のスクリーニング法・薬効評価法への応用を進めています。またディープラーニングによる新規なイメージング技術の開発にも取り組んでいます。
| 研究の応用領域 | 産官学連携で求めるパートナー |
|---|---|
| 医薬品・診断薬・医療機器の開発、創薬・医療機器分野の新技術開発 | がんと医薬品・診断薬・医療機器開発分野の研究者医薬品・診断薬・医療機器開発に取り組んでいる企業、大学、国・地方自治体の研究機関 |
Topics of research
Research and development of anticancer drugs targeting causative molecules of tumorigenesis have been actively promoted since discovery of human oncogenes in 1980s. The innovative molecular-targeted drugs such as Trastuzumab and Imatinib are typical fruits of the efforts for the past decade. Methodology developments and achievements of genomics research including completion of the human genome sequencing in 2003 are drastically changing the drug discovery system for cancer. Cancer medicine now enters an era of personalized medicine in which characteristics of a cancer and individual constitution of a patient are reflected in the therapeutic treatment. In accordance with the recent oncology R&D trend, Mizukami’s laboratory is aiming to explore fundamental technologies for drug discovery system and to discover novel cancer-causing genes and develop a new generation of molecular-targeted anticancer agents. Below are listed a few of recent research topics in this laboratory.
Topic-1: A human C18orf26 protein was designated dynAP (dynactin-associated protein) because of its interaction with dynactin subunits that comprised a microtubule-based motor protein complex. Importantly, the expression of dynAP activated Akt, whereas knockdown of dynAP abolished this activation. The ergosterol-related compounds identified by the yeast cell-based highthroughput screen abrogated activation of Akt and induced apoptosis in a dynAP-dependent manner. (Kunoh T. et. al, Mol Cancer Ther. 9, 2934-2942, 2010). NIH3T3/dynAP cells injected into nude mice produced tumors with abundant blood vessels and weak cell-cell contacts. The expression of dynAP increased the phosphorylation of AktSer473 that support cell survival and growth. The expression of dynAP also up-regulated the expression of angiopoietin-1 mRNA, an essential factor of angiogenesis, which may be responsible for abundant blood vessels in tumors. E-cadherin and its mRNA were markedly reduced upon expression of dynAP, giving rise to cells with higher motility, which may be responsible for the weak cell-cell adhesion in tumors. Thus, dynAP could be a new oncoprotein and a target for cancer therapy (Kunoh T. et al., PLoS One. e0135836, 2015).
Topic-2: Histone demethylases catalyze the removal of methyl groups on histone H3 lysine (H3K) residues and thereby influence epigenetic gene expression. Evidently methylation state of H3K is frequently involved in cell proliferation and survival in many cancers. Selective inhibitors of histone demethylases are candidate anticancer agents. We have successfully identified a battery of inhibitors of LSD1/LSD2 (Bioorg Med Chem Lett. 26, 1193-1195, 2016; J Med Chem. 59, 1531-1544, 2016; Med Chem Commun. 6, 407-412, 2015; Computational and Structural Biotechnology Journal. 9:e201402002, 2014; Biosci Biotechnol Biochem. 78, 1010-1017, 2014; Angew Chem Int Ed. 52, 8620-8624, 2013; Bioorg Med Chem. 19, 3702‒3708, 2011; J Am Chem Soc. 131, 17536‒17537, 2009) and Jumonji domain-containing protein-type JARID1A (ACS Med Chem Lett. 6, 665-670, 2015) , GASC1 (J Med Chem. 53, 5629-5638, 2010) and PHF8 (J Med Chem. 56, 7222‒7231, 2013). Further developmental studies are warranted based on these lead compounds.
主な業績論文等
- Kunoh T, Wang W, Kobayashi H, Matsuzaki D, Togo Y, Tokuyama M, Hosoi M, Koseki K, Wada S, Nagai N, Nakamura T, Nomura S, Hasegawa M, Sasaki R, Mizukami T: Human Dynactin-Associated Protein Transforms NIH3T3 Cells to Generate Highly Vascularized Tumors with Weak Cell-Cell Interaction. PLoS One. e0135836 (2015)
- Hasegawa M, Miura T, Kuzuya K, Inoue A, Ki, SW Horinouchi S, Yoshida T, Kunoh T, Koseki K, Mino K, Sasaki R, Yoshida M, Mizukami T: Identification of SAP155 as the Target of GEX1A (Herboxidiene), An Antitumor Natural Product. ACS Chem. Biol. 6, 229-233 (2011)
- Kunoh T, Noda T, Koseki K, Sekigawa M, Takagi M, Shin-ya K, Goshima N, Iemura S, Natsume T, Wada S, Mukai Y, Ohta S, Sasaki R, Mizukami T: A Novel Human Dynactin-Associated Protein, dynAP, Promotes Activation of Akt, and Ergosterol-Related compounds Induce dynAP-Dependent Apoptosis of Human Cancer Cells. Mol Cancer Ther. 9, 2934-2942 (2010)
- Mizukami T, Fuerst TR, Berger EA, Moss B : Binding region for human immunodeficiency virus(HIV)and epitopes for HIV-blocking monoclonal antibodies of the CD4 molecule defined by site-directed mutagenesis. Proc. Natl. Acad. Sci. U S A 85, 9273-9277(1988)
- Chaudhary VK, Mizukami T, Fuerst TR, FitzGerald DJ, Moss B, Pastan I, Berger EA Selective killing of HIV-infected cells by recombinant human CD4- Pseudomonas exotoxin hybrid protein. Nature 335,369-372(1988)






