アニマルバイオサイエンス学科
 中村 肇伸(なかむら・としのぶ)
中村 肇伸(なかむら・としのぶ)
Toshinobu Nakamura
専門分野/分子生物学、発生生物学、生殖細胞学
研究キーワード/全能性細胞、iPS細胞、再生医療
職位:アニマルバイオサイエンス学科長、教授
学位:博士(薬学)(大阪大学)
- 大阪大学大学院薬学研究科生命情報環境科学専攻博士後期課程修了
- 大阪大学微生物病研究所遺伝子動態研究分野研究員、大阪大学大学院生命機能研究科時空生物学病因解析学特任研究員、大阪大学大学院医学系研究科幹細胞病理学助教を経て本学へ
研究テーマ
1997年に体細胞クローン羊のドリーが報告され、分化した体細胞核が全能性を再獲得できることが示された。また、2006年には、体細胞に特定の転写因子を導入することにより、多能性幹細胞であるiPS 細胞が樹立され、再生医療への応用が期待されている。しかし、自然生殖による全能性の再獲得の効率は、クローン胚やiPS細胞による初期化と比べて圧倒的に高く、初期発生における全能性の再獲得の分子機構の解明は、効率よく体細胞核を初期化する方法の開発につながるという観点からも極めて重要である。当研究室では、哺乳類の着床前胚の発生過程および体細胞核初期化過程で生じる様々な現象について、その分子機構の解明を目指している。
(1)受精後の全能性再獲得の分子機構
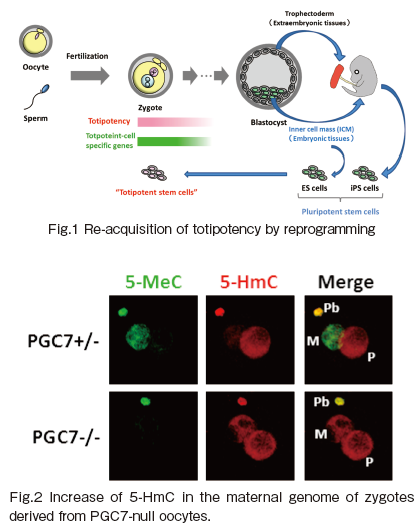
精子と卵子は次世代に遺伝情報を伝えるために存在する分化細胞であるが、受精を経て「全能性」と呼ばれる体を構成する全ての細胞に分化する能力を再獲得する(Fig.1)。我々は、全能性を有する受精卵から卵割期の間に特異的に発現する遺伝子群の同定に成功している。現在、ノックアウトマウスを用いて候補遺伝子が全能性の獲得に重要であるかどうかを検討している。
(2)全能性細胞の可視化とその誘導
胚性幹細胞(ES細胞)は、将来胎児を形成する内部細胞塊(ECM)が樹立した細胞であり、胎盤などの胚体外組織への分化能を失った多能性細胞であると信じられてきた。しかし、最近の研究から、ES細胞にはごくわずかに胚体外組織への分化能を維持した全能性細胞が含まれることが明らかにされている(Fig.1)。我々は、これらの細胞集団を可視化することに成功し、通常0.01%程度しか存在しない全能性細胞を約20%まで増加させることに成功している。現在、全能性を有したまま増殖することが可能な“全能性幹細胞” の樹立を目指し、研究を進めている。
(3)受精卵におけるエピジェネティックリプログラミング機構
受精後の核内では、精子と卵子に由来するクロマチンのエピジェネティックな情報が、初期胚型に書き換えられる。我々は、受精後に、雄性ゲノムに存在する5-メチル化シトシン(5-MeC)が5- ヒドロキシメチル化シトシン(5-HmC)に変換されることを発見した。また、雌性ゲノムに存在する5-MeC は、生殖細胞特異的に発現するPGC7(Stella、Dppa3)により5-HmCへの変換が阻害されていることを見出した(Fig.2)。最近、受精卵の雄性クロマチン特異的なヒストン修飾を見出しており、受精後のリプログラミングに関与するかどうかを検討している。
| 研究の応用領域 | 産官学連携で求めるパートナー |
|---|---|
| 医薬品・診断薬の開発、再生医療分野の新技術開発 | 幹細胞、再生医療、生殖医療分野の基礎・応用・臨床研究者医薬品・診断薬開発、再生医療、生殖医療の関連企業、大学、国・地方自治体の研究機関 |
Topics of research
During mammalian development, different cells and tissues acquire different programs of gene expression. Epigenetic regulations such as DNA methylation and histone tail modification play pivotal roles in this process, as well as transcriptional and translational regulation. A decade after cloning Dolly the sheep, the induction of pluripotency by transcription factors has been reported and brought about prospects for regenerative medicine. However, the establishment of topipotency during natural reproduction is exceedingly more efficient than in reproductive cloning or in transcription factor-based reprogramming. Understanding the molecular mechanisms directing acquisition of totipotency during early embryogenesis may enable to optimize the protocols for inducing reprogramming. We are investigating the mechanisms of epigenetic reprogramming occur after fertilization and during nuclear reprogramming
(1)Molecular mechanisms underlying totipotency.
Although the sperm and oocyte are highly specified cells to pass genetic information to next generation, they acquire totipotency, the ability to differentiate into any type of cell in the body, soon after fertilization. We have identified the genes specifically expressed in totipotent cells (totipotent-cell specific genes) in silico. We are investigating whether these genes are required for acquisition and/or maintenance of totioptency by gene disruption study in mice.
(2)Visualization and induction of totipotent cells within the ES cell clture.
Embryonic stem (ES) cells were thought to pluripotent cells, which lack the ability to make all extra-embryonic tissues. However, a recent study revealed that a rare fraction of ES cells culture, that expresses high levels of murine endogenous retrovirus with leucine tRNA primer (MuERV-L), have totipotency. We have identified totipotent cells in ES cell culture by visualizing the expression of MuERV-L, and found the culture condition which can efficiently induce totipotency . We are trying to generate “totipotent stem cells” which can differentiate to both embryonic and extraembryonic lineages using totipotent-cell specific genes.
(3)Epigenetic reprogramming in fertilized egg.
After fertilization, paternal genome undergoes epigenetic reprogramming, whereas the maternal genome appears epigenetically more static. We found that 5-methylcytosine (5-MeC) was converted to 5-hydroxymethylcytosine (5-HmC) in paternal genome after fertilization. Furthermore, we found that PGC7 (also known as Stella and Dppa3) protects the maternal genome from the conversion of 5MeC to 5-HmC. Recently, we found that novel histone modification is present in the paternal chromatin. We are investigating whether this modification is required for epigenetic reprogramming in zygote.
主な業績論文等
- Hatanaka Y, Tsusaka T, Shimizu N, Morita K, Suzuki T, Machida S, Satoh M, Honda A, Hirose M, Kamimura S, Ogonuki N, Nakamura T, Inoue K, Hosoi Y, Dohmae N, Nakano T, Kurumizaka H, Matsumoto K, Shinkai Y, Ogura A., Histone H3 methylated at arginine 17 is essential for reprogramming the paternal genome in zygotes. Cell Rep, 20, 2756-2765 (2017)
- Xu X*, Smorag L*, Nakamura T*, Kimura T, Dressel R, Fitzner A, Tan X, Linke M, Zechner U, Engel W , Pantakani K. (*co-f irst authors), Dppa3 expression is critical for generation of fully-reprogrammed iPS cells and maintenance of Dlk1-Dio3 imprinting. Nat Commun., 6, 6008 (2015)
- Nakamura T, Liu YJ, Nakashima H, Umehara H, Inoue K, Matoba S, Tachibana M, Ogura A, Shinkai Y, Nakano T., PGC7 binds histone H3K9me2 to protect against conversion of 5MeC to 5HmC in early embryos. Nature, 486, 7403, 415-419 (2012)
- Wossidlo M, Nakamura T, Lepikhov K, Marques CJ, Zakhartchenko V, Boiani M, Arand J, Nakano T, Reik W, Walter J., 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming. Nat Commun., 2, 241 (2011)
- Nakamura T, Arai Y, Umehara H, Masuhara M, Kimura T, Taniguchi H, Sekimoto T, Ikawa M, Yoneda Y, Okabe M, Tanaka T, Shiota K, Nakano T., PGC7/ Stella protects against DNA demethylation in early embryogenesis, Nature Cell Biol.,9, 1, 64-71 (2007)






