フロンティアバイオサイエンス学科 臨床検査学プログラム
 吉川 清次(よしかわ・きよつぐ)
吉川 清次(よしかわ・きよつぐ)
Kiyotsugu Yoshikawa
専門分野/腫瘍医学、分子生物学
研究キーワード/癌の不均一性、核酸医薬、上皮間葉転換解除、腫瘍微小環境リプログラミング
職位:教授
学位:医学博士(京都大学)
- ・京都大学大学院医学研究科博士課程外科系専攻
- ・京都大学大学院医学研究科分子生物学研究員
- ・京都大学放射性同位元素総合センター助手
- ・京都大学医学研究科知的財産経営学コース科学技術振興講師、外来化学療法部医師兼務
- ・ダナファーバー癌研究所リサーチフェロー
- ・京都大学医学研究科メディカルイノベーションセンター特定准教授
- ・武田薬品工業メディカルダイレクターを経て本学へ
研究テーマ
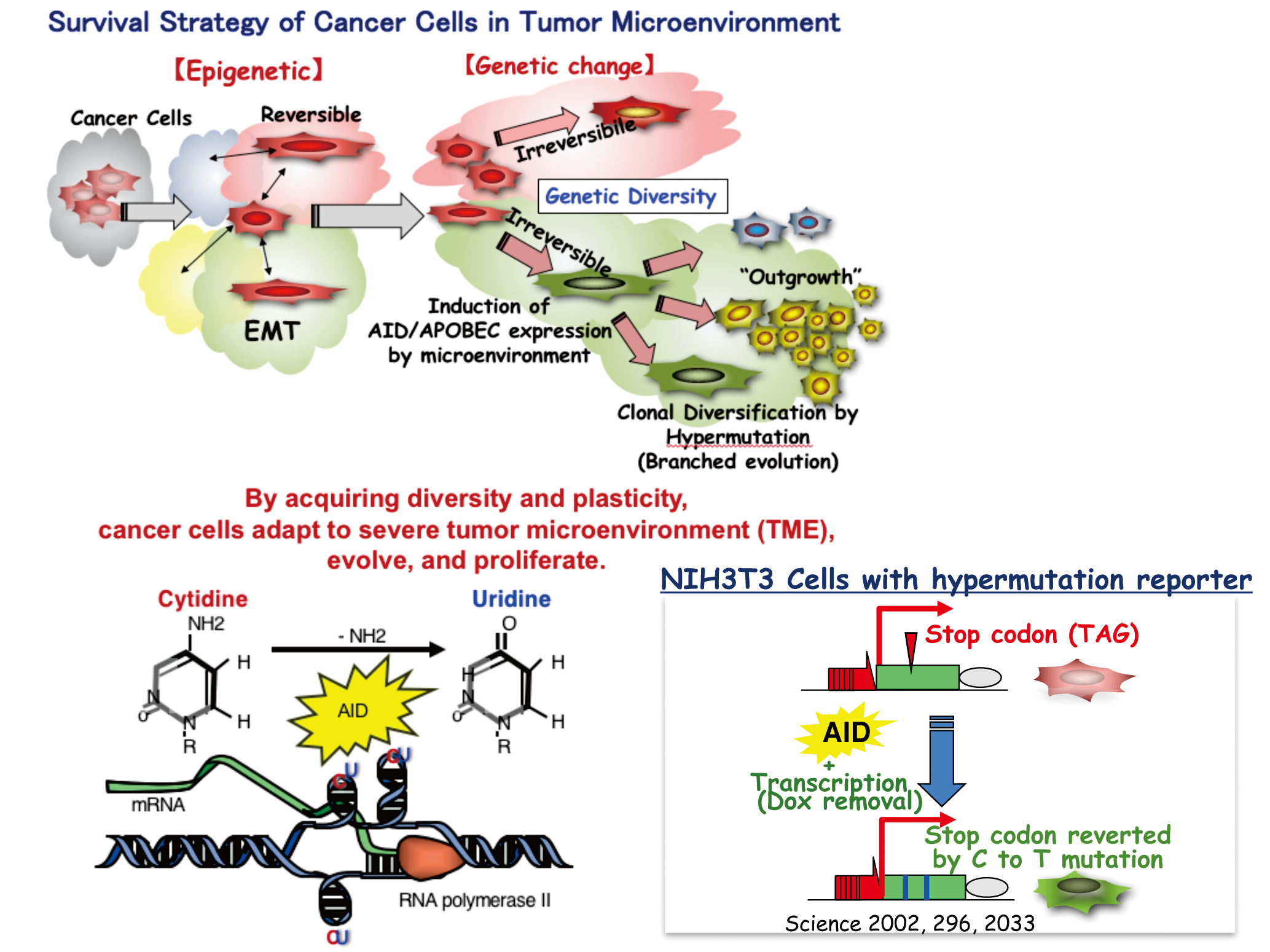
外科研修医時代に初めて担当した乳がん患者さんの腹壁を通して感じた腹膜転移のゴツゴツ感は、未だに手に残ったその感触が忘れられない。以後がんの根治が人生のテーマになった。この半世紀がんの分子機構の解明が進み分子標的薬が開発され、がん治療の選択肢は格段に増えた。近年は免疫チェックポイント阻害剤の登場、次世代シークエンス技術( NGS)によるプレシジョンメディシン時代の到来で、今まさにがん治療は変革の時を迎えている。その一方で解析が進むほど見えてくるのはがんの多様性・不均一性・可塑性である。
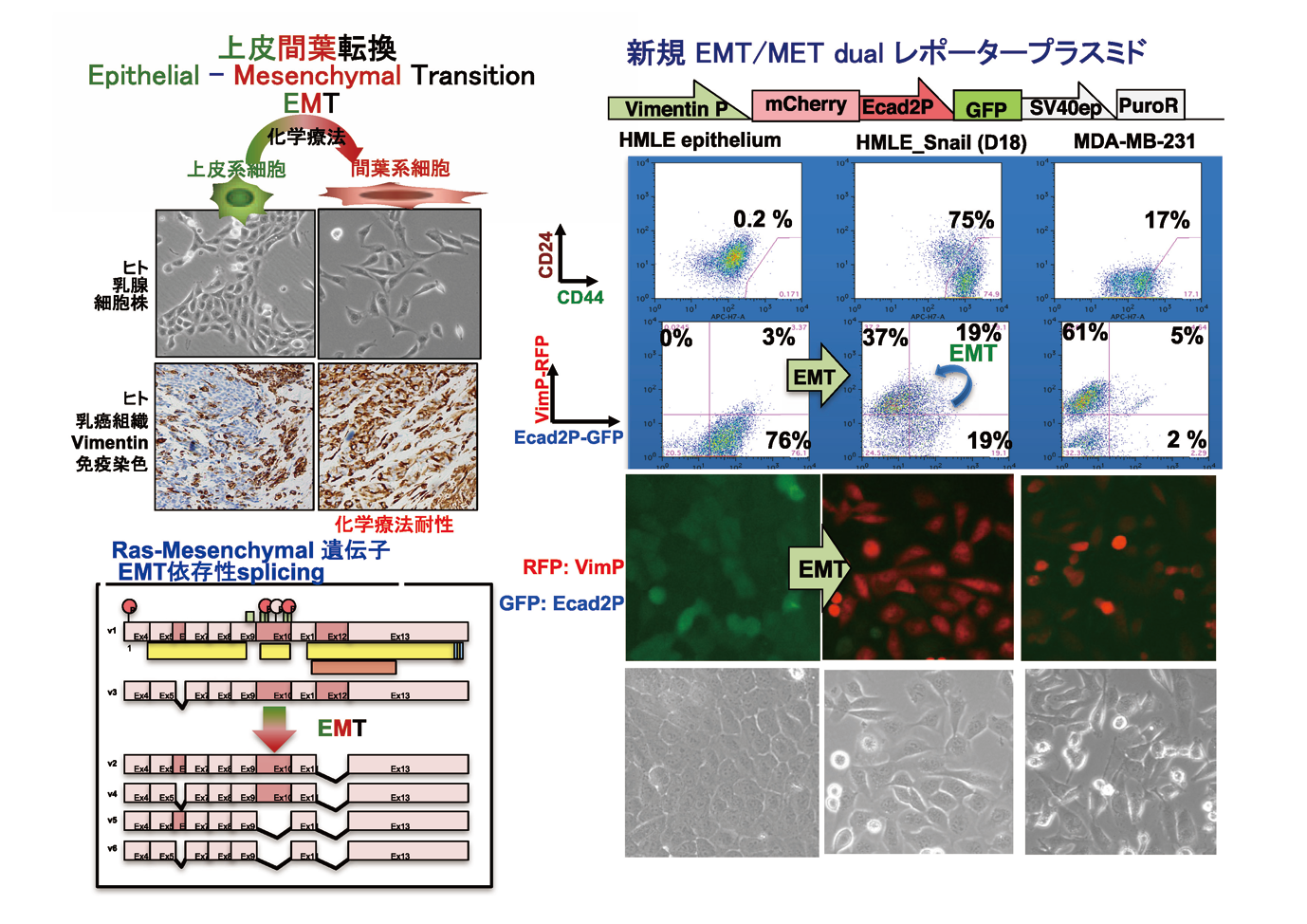
(1) 上皮間葉転換の制御
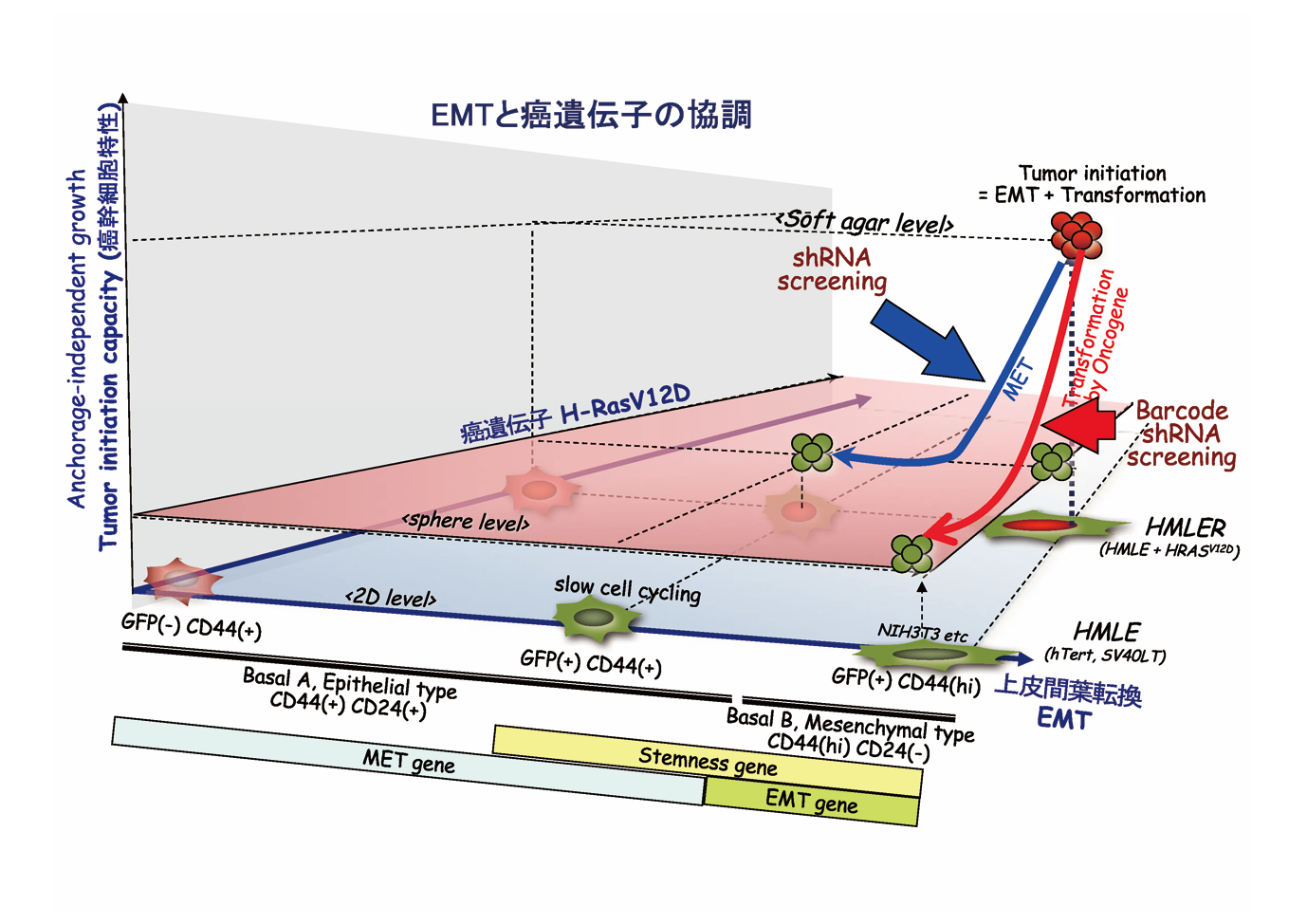
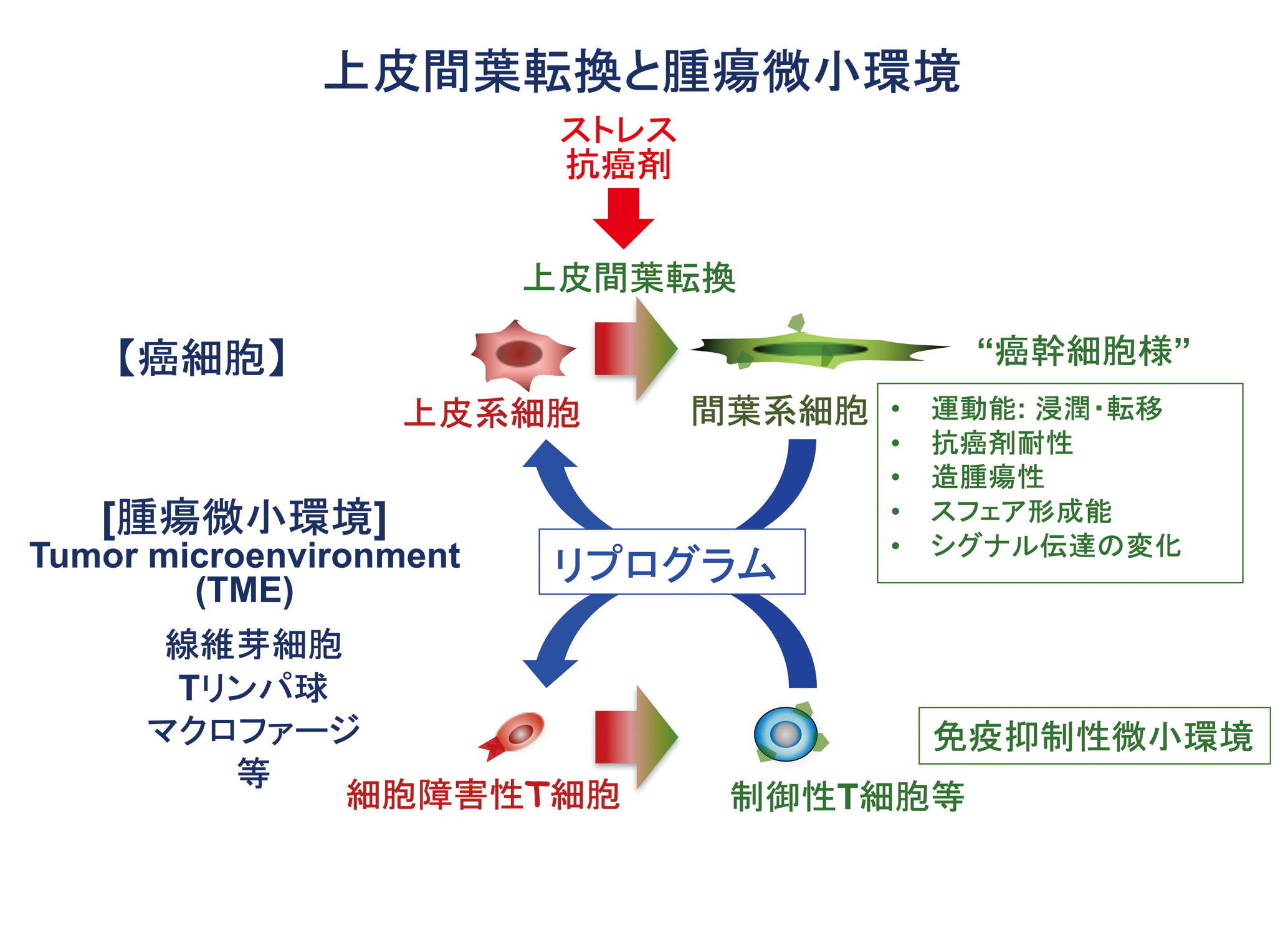
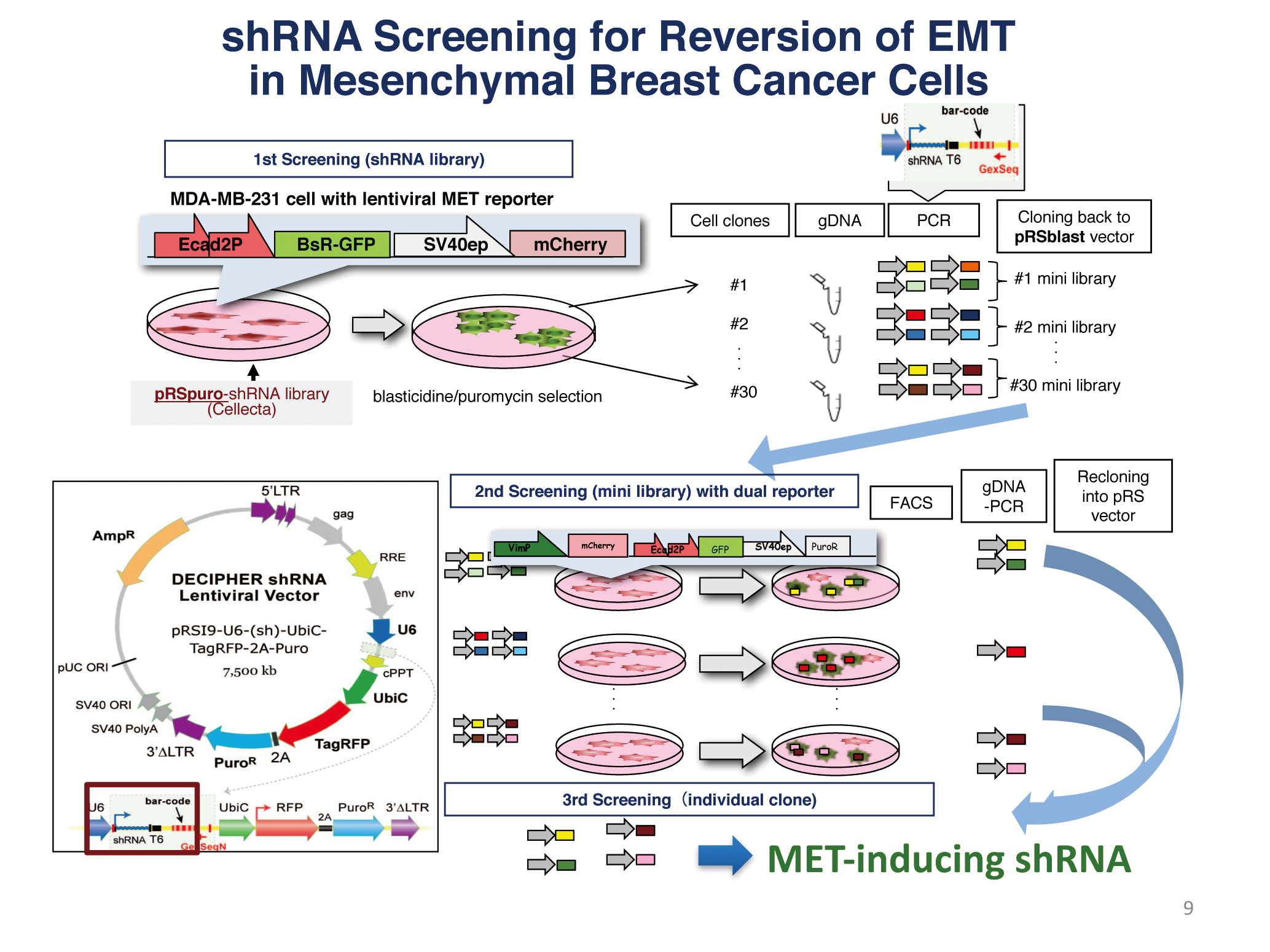
上皮間葉転換は、がんの多様性・不均一性・可塑性の主要因と考えられる。分子標的が未だ同定されていないホルモン受容体・HER 2陰性のトリプルネガティブ乳がん (TNBC)のがん幹細胞分画は上皮間葉転換 (epithelial-mesenchymal transition, EMT)を呈する。我々は新規EMT / METレポーターを開発し網羅的shorthairpin RNA( 短ヘアピンRNA: shRNA) ライブラリーのスクリーニングにより、強力なMET活性を持つshRNAを複数同定した。shRNAの1つはDNA 修復阻害活性を同時に合わせ持ち、TNBC 乳がん・膠芽腫( 悪性度の高い脳腫瘍の1つ)強力な増殖抑制効果を示し、上皮化による薬剤感受性の回復効果と増殖抑制効果の両方を持つ新規治療法としての可能性を持っている。またRas癌遺伝子導入間葉系がん細胞で発現が上昇し、上皮間葉転換に際しスプライシングが変化し、間葉系がん細胞の分化・増殖に関わる遺伝子( Ras間葉系遺伝子)を同定している。これらMET誘導shRNA・Ras間葉系遺伝子の作用機序の解明を進め新規治療への応用を目指す。さらに上皮化を誘導するshRNA が免疫抑制性の癌微小環境をリプログラムする可能性を追求する。
(2) DNA 多様性の源 :AID / APOBEC核酸編集酵素群
AID / APOBEC ファミリー群は核酸編集機能を持つ進化上保存された遺伝子である。AIDは抗体遺伝子のDNAの組換え・体細胞突然変異に関わる一方、APOBEC遺伝子は、脂質代謝のmRNA編集、HIVゲノムの編集に関わることが報告されているが、がんNGSの解析にてAPOBEC 遺伝子群ががんのDNA 不均一性を増加させていることが示唆されている。EMT—APOBEC 遺伝子群—がん免疫に対する影響を解析し、がんの多様性を標的にした治療法開発を目指す。
| 研究の応用領域 | 産官学連携で求めるパートナー |
|---|---|
| 医薬品、核酸医薬の開発 | 医薬品開発企業、大学などの研究機関 |
Topics of research
As a physician-scientist, I have seen cancer patients with metastatic and therapy-resistant disease and have found most of the recurrences progress along with acquisition of drug resistance. Epithelial-mesenchymal transition (EMT), a process in which epithelial cells are converted to fibroblast-like mesenchymal cells and are conferred with diversity, heterogeneity and plasticity, is responsible for their drug resistance, invasiveness and stemness. In order to find new targets in cancer cells with EMT property, we have developed a novel EMT/MET dual reporter and have identified short hairpin RNAs (shRNAs), which reverse mesenchymal properties toward epithelialization. One shRNA has unique features with both growth-suppressing, in addition to MET, capabilities in a broad range of malignant cells including TNBC and glioblastoma, both of which are malignancies difficult to treat. We have also identified EMT-specific splicing of a Ras/ mesenchymal gene, so called due to its increased expression in Ras-introduced mesenchymal cancer cells and loss of which strongly suppressed tumorigenicity of triple-negative breast cancer (TNBC) cells. We will explore the therapeutic possibility of both the MET-inducing shRNA and the Ras/mesenchymal gene as both novel cancer-targeting and tumor microenvironment-reprogramming strategies. Recent data suggests that AID/APOBEC family members may play a role to generate genetic diversity and heterogeneity of cancer cells, which is called Kataegis, a local hypermutation in cancer genome. We are now establishing the system where hypermutation and EMT status can be modulated artificially and try to understand the novel treatment strategy including immunomodulation.
主な業績論文等
- Shi G, Yoshida Y, Yuki K, Nishimura T, Kawata Y, Kawashima M, Iwasako K, Yoshikawa K, Kurebayashi J, Toi M, Noda M. Pattern of RECK CpG methylation as a potential marker for predicting breast cancer prognosis and drug sensitivity. Oncotarget, 7(50), 82158-82169, 2016
- Yi T, Zhai B, Yu Y, Yoshikawa K, Raschle T, Etzkorn M, Seo HC, Nagiec M, Luna RE, Reinherz EL, Blenis J, Gygi SP, Wagner G. Quantitative phosphoproteomic analysis reveals system-wide signaling pathways downstream of SDF-1/CXCR4 in breast cancer stem cell. Proc Natl Acad Sci U S A. 27;111(21):E2182-90. 2014
- Okazaki IM, Okawa K, Kobayashi M, Yoshikawa K, Kawamoto S, Nagaoka H, Shinkura R, Kitawaki Y, Taniguchi H, Natsume T, Iemura S, Honjo T. Histone chaperon Spt6 is required for class switch recombination but not somatic recombination. Proc. Natl. Acad. Sci. USA. 108(19):7920-5. 2011
- 吉川清次 “乳癌幹細胞特性とepithelial-mesenchymal transition” 2010 June: 65:1331-1342. 乳癌研究の最前線、最新医学社
- Yoshikawa K, Okazaki I, Eto T, Kinoshita K, Muramatsu M, Nagaoka H, Honjo T. AID enzyme-induced hypermutation in an actively transcribed gene in fibroblasts. Science 296: 2033-2036, 2002
- Yoshikawa K., Honda K., Inamoto T., Shinohara H., Yamauchi A., Suga K., Okuyama T., Shimada T., Kodama H., Noguchi S., Gazdar F. A., Yamaoka Y., and Takahashi R. Reduction of BRCA1 Protein Expression in Japanese Sporadic Breast Carcinomas and its Frequent loss in BRCA1-Associated Cases. Clin. Cancer Res., 5: 1249-1261, 1999.






